Редкий биохакер не упомянет, что надо «качать» и «обновлять» митохондрии, если хочешь дожить до 100+ лет. Стоп, задушним, а о чем на самом деле речь? Как устроен наш организм и почему он (действительно!) зависит от этих клеточных структур? Что такое инфламейджинг и свободные радикалы и какую роль здесь играют они? Вот строго научный, подробный и — самое главное — понятный ликбез, которым поделился лауреат Нобелевской премии по химии-2009, один из самых авторитетных биохимиков в мире, Венки Рамакришнан — в книге «Почему мы умираем».
Откуда произошли мы (и наши митохондрии)
Первыми формами жизни на Земле были одноклеточные существа, плававшие в первичном бульоне. Как же из них развились мы, люди? Любая клетка нашего тела значительно крупнее и гораздо более сложно устроена, чем типичная бактерия, и даже сейчас остается загадкой, как могла появиться хотя бы одна столь сложная клетка. В начале 1900-х гг. русский ботаник Константин Мережковский предположил, что крупная клетка поглотила меньшую, менее сложную. Само по себе это в порядке вещей: обычно крупная клетка захватывает и переваривает меньшую, либо—если «откусила» больше, чем может «прожевать»,— сама погибает от несварения. Мережковский же предположил, что однажды в такой ситуации выжили обе клетки — и поглотившая, и поглощенная, — и с тех пор продолжают сосуществовать и воспроизводиться как единое целое. Эта гипотеза просуществовала не одно десятилетие, прежде чем получила признание: в 1960-е гг. ее принялась разрабатывать биолог Линн Маргулис.
[...] Маргулис считала, что симбиоз — это широко распространенное явление, а эукариоты (более сложные клетки с ядром) появились как результат симбиотических отношений между бактериями. В то время преобладала догма, что простейшие бактерии постепенно эволюционировали в более сложные одноклеточные эукариотические формы. Гипотезу Маргулис можно было рассматривать как развитие идей Мережковского, высказанных почти за 60 лет до этого, и все же ее представления казались настолько спорными, что пятнадцать научных журналов отклонили ее статью, прежде чем та была опубликована в Journal of Theoretical Biology (1967) за подписью Линн Саган.
Маргулис предположила, что потомство бактерий, когда-то проглоченных более крупными клетками, продолжает ныне существовать в качестве их органелл. В клетках животных эти органеллы известны нам как митохондрии. В растительных клетках кроме митохондрий есть и другие потомки бактерий: хлоропласты, в которых происходит фотосинтез — процесс, в ходе которого энергия солнечного света улавливается хлорофиллом и используется для синтеза сахаров из углекислого газа и воды. И ни мы, ни растения не можем существовать без этих «пассажиров».
В настоящее время ученые считают, что ключевое событие, приведшее к появлению эукариотов, произошло приблизительно 2 млрд лет назад, когда один одноклеточный организм — архея, или архебактерия, — поглотил другую бактерию, поменьше. Вопреки всему поглощенная бактерия выжила, вступила в симбиотические отношения с хозяином архебактерией, а затем постепенно эволюционировала в митохондрию.
Так что же имеется в виду, когда говорят, что митохондрия производит энергию
Сравните современный мир с доиндустриальным, более примитивным. В том мире было много разных источников энергии. Можно было использовать энергию солнца, чтобы согреться, или сжигать на огне дрова и иное топливо для получения тепла; можно было использовать энергию текущей воды или ветра, чтобы вращать мельничные жернова; пересекать океаны с помощью энергии ветра. Однако эти источники энергии не заменяют друг друга и имеют весьма ограниченное применение. Например, вы не можете использовать ветер для приготовления пищи.
А теперь посмотрим на современный мир: практически любой вид энергии, от солнечной и ветровой до энергии ископаемого топлива и расщепленного атома, может быть преобразован в электричество. А электричество, в свою очередь, можно использовать практически для любых целей. Оно дает тепло и свет, позволяет перемещаться в машинах и поездах, развлекает с помощью телевизоров, компьютеров и других устройств и обеспечивает мгновенную связь с любой точкой мира. Электричество стало универсальной энергетической валютой — во многом так же, как столетия назад с появлением денег простой товарообмен был замещен товарно-денежным обращением.
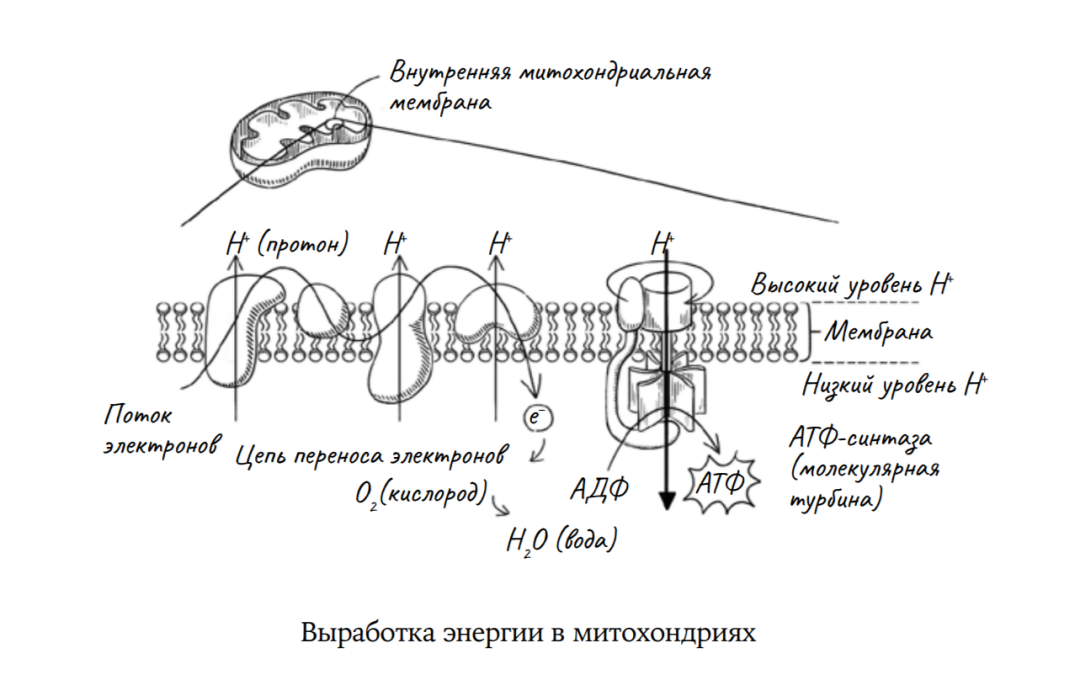
Ровно то же самое делают в клетке митохондрии. Они берут менее универсальную форму энергии — например, заключенную в углеводах, которые мы потребляем, — и преобразуют в универсальную энергетическую валюту клеток, которой является молекула аденозинтрифосфата, или АТФ. Мы уже говорили об АТФ — это нуклеозид, в состав которого входят азотистое основание аденин, остаток моносахарида рибозы и цепь из трех остатков фосфорной кислоты. Связи между фосфатными группами относятся, говоря языком химии, к типу макроэргических. Для их формирования требуется много энергии, и эта же энергия высвобождается при их разрушении. Когда клетке нужна энергия для какого-либо процесса, она получает ее, разрывая связь между второй и третьей фосфатными группами, и использует высвобождающуюся в результате энергию. АТФ — это что-то вроде миниатюрной и весьма подвижной клеточной батарейки.
В процессе усваивания пищи, в особенности богатой углеводами, мы эффективно сжигаем сахара, которые получили в результате расщепления этих углеводов. Строго говоря, с точки зрения химии это то же самое, как если бы мы сжигали сахар (глюкозу) на огне, только наши клетки полностью контролируют весь процесс. Итог в обоих случаях один: глюкоза соединяется с кислородом, образуя углекислый газ и воду, и в результате этого процесса выделяется энергия. Именно это происходит, когда мы дышим. Энергия, высвобожденная в процессе дыхания, используется митохондриями для синтеза АТФ. [...]
Что такое АТФ (простым языком!) и почему она жизненно важна
Как изобретение денег резко оживило торговлю и подняло уровень жизни, позволив сформироваться высокоорганизованным обществам, а «энергетическая валюта» в виде электричества открыла дорогу развитию сложнейших технологий, так и эффективное производство АТФ дало клеткам возможность усложняться и специализироваться.
АТФ — это небольшая молекула, и она при необходимости перемещается по всей клетке. Она поставляет энергию для всех процессов: от производства компонентов клетки и перемещения ее отдельных частей до передвижения самих клеток.
Мышцы используют АТФ, чтобы генерировать энергию для сокращения. В нашем мозге АТФ создает электрическое напряжение на мембранах нейронов для передачи электрических сигналов и генерации импульсов. Общее количество АТФ, образующееся за сутки в организме человека, сопоставимо с массой его тела, причем пятую часть всего АТФ потребляет мозг. Работа мысли сама по себе требует нескольких сотен калорий в день. И почти весь этот объем производят митохондрии. Эти безбилетные пассажиры — изначально, видимо, паразиты — стали нам незаменимыми помощниками, вырабатывая АТФ, без которого мы не можем обойтись.
От своих бактериальных предков митохондрии отличаются и по ряду других аспектов. Например, они утратили почти все свои гены и сегодня митохондриальный геном очень мал и содержит чуть более десятка генов, кодирующих белки. Структурные части митохондрии более чем на 99﹪ кодируются генами, находящимися на хромосомах в ядре клетки. Эти белки синтезируются в цитоплазме наших клеток и затем с помощью сложного механизма импортируются сквозь одну или обе мембраны в митохондрию. Как и почему митохондрия сумела передать бо́льшую часть своих генов в геном организма-хозяина и зачем она все-таки сохранила часть своего генома, мы точно не знаем. При этом малый митохондриальный геном создает немало проблем: мутации в митохондриальной ДНК могут вызывать болезни, в том числе диабет, сердечную и печеночную недостаточность и такие расстройства, как глухота.
Мы наследуем митохондрии только от матери, потому что сперматозоид не передает свои митохондрии при слиянии с яйцеклеткой
Таким образом, болезни, возникающие из-за дефектов в митохондриальном геноме, передаются исключительно по материнской линии. Несколько лет назад в Великобритании семьям законодательно разрешили иметь «детей трех родителей». Ядро яйцеклетки потенциальной матери с дефектами в митохондриях переносится в яйцеклетку с удаленным ядром, взятую у здоровой женщины. Затем яйцеклетка оплодотворяется сперматозоидом отца и помещается в матку потенциальной матери. У ребенка будут в основном гены от отца и матери, но все митохондрии с их крошечным геномом достанутся от женщины — донора яйцеклетки.
В клетке может содержаться от десятков до тысяч митохондрий
Эти митохондрии не ведут полностью самостоятельное существование, как если бы они были бактериями, развивающимися в культуре. Вместо этого они непрерывно сливаются и разделяются. Митохондрии могут сливаться и смешивать содержимое отчасти для того, чтобы компенсировать поврежденные элементы в каждой из них. Делятся же они разными способами. При делении клетки митохондрия тоже делится, часто прямо посредине. Но иногда она отделяет дефектные части, чтобы их можно было отправить на утилизацию с помощью, например, такого механизма, как аутофагия. При этом митохондрии сливаются не только друг с другом: они разными любопытными способами взаимодействуют с другими органеллами клетки.
Оказывается, липиды — молекулы жиров, из которых состоят клеточные мембраны,— узкоспециализированы, поэтому у разных типов клеток и разных органелл свои комбинации липидов. Митохондрии нередко обмениваются компонентами с другими органеллами, чтобы те могли помогать друг другу в производстве необходимых липидов. Причем избыток контактов между этими органеллами и митохондриями может быть столь же пагубным, как и недостаток.
Наконец, митохондрии выполняют множество других функций помимо производства АТФ
Например, именно они оказываются тем местом, где происходит последний этап сгорания сахаров. В них же сжигается запасенный жир, что особенно важно, когда организм недополучает углеводов, например, когда мы голодаем или сидим на диете. Энергия от сжигания жиров также направляется на производство АТФ. Кроме генерации энергии у митохондрий есть свои функции в сложной сигнальной сети, охватывающей всю клетку. Они сообщают клетке, что уровень энергии упал или возрос, чтобы клетка адаптировалась, включая и отключая соответствующие гены и сигнальные пути. Таким образом, митохондрии ныне выполняют роль не просто электростанций, они стали центральным звеном клеточного метаболизма, и это уже далеко не те безбилетные пассажиры бактерии в более крупных клетках, которыми они некогда были. Теперь мы сосуществуем с ними, связанные сложными взаимоотношениями.
С возрастом, хотя наши митохондрии продолжают работать, в них постепенно накапливаются повреждения
Кроме того, что они начинают менее эффективно вырабатывать энергию, они сами изнашиваются и не так хорошо выполняют множество других задач. Пожалуй, ни одна другая структура в клетке не связана так тесно с избытком энергии в юности и угасанием в старости. Стареющие митохондрии даже меняют форму в процессе деградации, превращаясь из продолговатых «дынек» в круглые пузырьки. Теперь вы понимаете, почему мой внук — с молодыми, здоровыми митохондриями — чувствует себя намного энергичнее и в целом более здоровым, чем я.
Если митохондрии не могут работать на каком-то определенном минимальном уровне, мы умираем
Напомню, что в большинстве стран смерть констатируют, когда прекращается работа мозга. Если организм не в состоянии обеспечить мозг кислородом и сахаром — такое случается по разным причинам, например при сердечном приступе, — митохондрии в тканях мозга не могут произвести нужный для работы нейронов объем АТФ и мозг погибает. Внезапное отключение кислорода из-за сердечного приступа — случай критический, но даже при нормальном течении жизни митохондрии постепенно ослабевают и в какой-то момент уже не могут работать с нужной эффективностью. Что приводит к такому исходу?
Митохондрии стареют по тем же причинам, что и все клетки, но у них также есть и свои собственные трудности. В 1954 г.Денхам Харман предложил гипотезу, получившую название «свободнорадикальная теория старения». Смысл ее заключался в том, что химически активные виды молекул — некоторые из них называются свободными радикалами—обычно образуются как побочный продукт обмена веществ и со временем наносят клетке ущерб, ускоряя старение. На первый взгляд, гипотеза Хармана помогает понять пользу ограничения калорий. Меньше ешь — сжигаешь в день меньше калорий, производишь не так много вредного побочного продукта. Кроме того, свободнорадикальная теория объясняет, почему животные с быстрым обменом веществ живут, как правило, меньше, чем виды с медленным метаболизмом.
Свободные радикалы образуются по всей клетке, но в митохондриях и они, и другие активные вещества образуются в изобилии. Главная функция митохондрии—сжигание сахара путем его окисления. Кислород, который мы вдыхаем, состоит из двух крепко связанных атомов, образующих молекулу O2 . В митохондрии он восстанавливается до двух молекул воды (H2O). Если восстановление кислорода не завершено, остаются частично восстановленные молекулы — высокоактивные промежуточные соединения, которые называются активными формами кислорода или АФК. И эти чрезвычайно активные формы кислорода могут вызвать повреждение различных компонентов клетки, в том числе белков и ДНК.
Как правило, в митохондриях имеются особые ферменты, которые удаляют опасные активные молекулы, прежде чем те успеют причинить вред, но этот механизм не безупречен. Часть свободных радикалов от него ускользает. И со временем они разрушают соседние молекулы, в том числе белки, обеспечивающие работу клетки. Нарушение функции клетки ведет к старению. Но кроме непосредственного вреда эти активные молекулы способны влиять на будущие поколения митохондрий, повреждая митохондриальную ДНК. Эта ДНК кодирует части важнейшего механизма окисления сахара и выработки АТФ, и, если в ней накапливается слишком много мутаций, механизм окажется неисправным. А это, в свою очередь, ведет к снижению эффективности восстановления кислорода, т.е. активных частиц будет оставаться еще больше, и возникнет порочный круг. Свободные радикалы могут также просачиваться в другие части клетки и разрушать их. Поэтому с возрастом митохондрии будут работать все хуже и хуже. [...]
С момента широкого признания теории свободных радикалов в центре внимания оказались антиоксиданты
Эти соединения, атакующие АФК, превозносили как панацею от любых болезней, включая рак и старение. Резко пошли в рост продажи таких антиоксидантов, как витамин E, бета-каротин и витамин C. Косметические компании принялись добавлять витамин E, ретиноевую кислоту и другие антиоксиданты в лосьоны и кремы для омоложения кожи. Людей убеждали есть продукты, богатые антиоксидантами, например брокколи и белокочанную капусту. Увы, хотя отдельные исследования подтвердили пользу антиоксидантов, анализ результатов 68 рандомизированных клинических исследований пищевых биодобавок с антиоксидантами, охвативших 230000 участников, показывает, что эти вещества не снижают смертность, более того, некоторые из них — бета-каротин, витамин A, витамин E — даже повышают ее. Сам по себе такой результат не подразумевает, что теория свободных радикалов не имеет под собой оснований. Однако это означает, что прием добавок с антиоксидантами не дает особой защиты от вреда, наносимого свободными радикалами. Впрочем, не спешите выбрасывать из рациона капусту: свежие фрукты и овощи полезны во многих других отношениях.
Итак, если свободные радикалы и активные формы кислорода сами по себе не являются основной проблемой, то какие еще митохондриальные процессы можно рассматривать как факторы старения
Мы знаем, что мутации митохондриальной ДНК множатся с возрастом, а накопление этих мутаций связано с болезнями. Но вызывают ли они старение? Один из способов выяснить это — создать путем генной инженерии линию мышей, у которых фермент ДНК-полимераза, реплицирующий митохондриальную ДНК, более подвержен сбоям, соответственно, мутации у них будут накапливаться быстрее. Эти мыши-мутанты при рождении казались вполне нормальными, но вскоре у них проявлялись многие симптомы преждевременного старения, включая седину, ухудшение слуха и сердечные расстройства. К возрасту 60 недель большинство из них умирали, нормальные же мыши в этом возрасте еще продолжают жить. Так было получено неопровержимое доказательство того, что повреждение митохондриальной ДНК — важный фактор старения. Примечательно, что у этих мутантов не повышался уровень АФК, следовательно, дело не в том, что рост мутаций приводит к образованию дефектных ферментов, которые еще более усугубляют проблему, способствуя накоплению АФК. Главная причина, по которой мыши с данной мутацией стареют быстрее, пока не выявлена. Имеются данные, свидетельствующие о сложном взаимодействии между дефектами митохондриальной ДНК и стабильностью основной части генома в клеточных ядрах, которое может быть причиной всех более общих проблем, связанных с нарушением ДНК.
Нет никаких сомнений в том, что повреждения митохондрий вредны для клетки и ускоряют старение, однако установить точные причины повреждений достаточно непросто. Клетка человеческого организма может нести в себе от десятков до тысяч митохондрий, у каждой из которых есть собственный геном. И если в ДНК каких-то из них обнаруживаются серьезные повреждения, оставшихся здоровых митохондрий все равно обычно хватает для того, чтобы клетка функционировала. Но в какой-то момент достигается порог, когда поврежденных митохондрий в клетке становится слишком много, и это вызывает столько проблем, что здоровые митохондрии справиться с ними не в состоянии.
Бывают и такие ситуации, когда некоторые из поврежденных митохондрий начинают размножаться быстрее, потому что перестают выполнять всю ту работу, которая теперь достается здоровым митохондриям. И тогда клоны дефектных органелл могут возобладать, что приводит к серьезным неприятностям для клетки. Митохондрии не просто генераторы энергии: они глубоко вовлечены в метаболизм клетки. И, накапливая с возрастом повреждения, они способствуют угасанию функций клетки, в которой живут, и ускоряют старение. И этот эффект особенно отчетливо проявляется при увядании стволовых клеток, поскольку они играют такие важные и разнообразные роли. Когда эти клетки перестают функционировать, они не только больше не могут восстанавливать ткани, но и вызывают клеточное старение и хроническое воспаление, а это все — признаки общего старения организма.
Хроническое слабое воспаление — неизменный спутник старения, и потому его метко назвали инфламейджингом
Своим существованием инфламейджинг обязан отчасти бактериальной природе далеких предков нашей митохондрии. Старые и дефектные митохондрии легко разрушаются, и их ДНК и другие молекулы попадают в цитоплазму клетки. Клетка принимает их за молекулы чужеродных бактерий и запускает воспалительный процесс. В человеческих нейронах, которые живут чрезвычайно долго, митохондрии особенно подвержены старению. В этом может заключаться одна из причин снижения когнитивных способностей в пожилом возрасте. Помимо прочего, нейроны со стареющими митохондриями менее успешно используют рециркуляционные сигнальные пути, которые помогают утилизировать дефектные белки и органеллы, расходующие энергию. В итоге с возрастом мы все менее устойчивы к деменции. Все это говорит о том, что поддержание работоспособности митохондрий — необходимое условие хорошего здоровья организма. И механизм, с помощью которого клетки этого добиваются, тесно связан с некоторыми сигнальными путями, задействованными при ограничении потребления калорий.
Клетка применяет аутофагию, чтобы избавиться от целых митохондрий, которые она определяет как дефектные, и даже от оторвавшихся дефектных частей митохондрий. Процесс отбора митохондрий для их утилизации и переработки называется митофагией. Некоторые особые белки способны распознавать когда что-то идет не так,—они покрывают поверхность поврежденной митохондрии маркерами, которые сигнализируют системе аутофагии, что эту митохондрию надо утилизировать. Ограничение калорий, которое повышает уровень аутофагии через сигнальные пути TOR, также активизирует и митофагию.
Избавляясь от поврежденных митохондрий, клетка должна заменять их новыми: и здесь ограничение калорий тоже может сыграть свою роль. Ингибирование TOR ограничением калорий или приемом рапамицина останавливает синтез многих белков, но запускает производство других белков, участвующих в образовании новых митохондрий.
Исследования на дрозофилах показали, что возросшая в результате этих процессов митохондриальная активность напрямую связана с увеличением срока жизни мушки. Помимо TOR образование новых митохондрий стимулируют и другие сигналы. Впрочем, иногда эти усилия ни к чему не приводят: обнаружив проблемы с митохондриальной функцией, клетка может просто начать производить новые дефектные митохондрии.
Существует простой, причем абсолютно бесплатный способ стимулировать образование новых митохондрий — физическая активность
Она включает часть сигнальных путей, стимулирующих производство митохондрий в разных тканях организма, от мышц до мозга. И здесь тоже налицо пример гормезиса. Излишнее физическое напряжение может повредить, и даже не слишком интенсивные упражнения могут на время повысить кровяное давление, окислительный стресс и воспаление, а это все может быть опасно для здоровья. Однако, пока нагрузка не чрезмерна и не опасна — а это определяется общим состоянием здоровья человека и целым рядом индивидуальных особенностей, — она приносит огромную пользу. Один из путей, которыми она усиливает митохондриальную функцию, — это генерация активных соединений кислорода, образующихся при неполном окислении в процессе дыхания. Эти соединения могут быть полезными для организма, если только их количество не чрезмерно. Разумеется, польза физической нагрузки не исчерпывается этим: она снимает стресс, поддерживает мышечную и костную массу, помогает бороться с диабетом и ожирением, улучшает сон и усиливает иммунитет. И добавьте к этому списку оздоровительный эффект от появления свеженьких митохондрий.




Комментарии (0)